分泌タンパク質にジスルフィド結合を形成する仕組みの詳細を解明
本研究科動物細胞工学講座(河野研究室)の門倉広研究員(国際リサーチフェロー)は、分泌タンパク質にジスルフィド結合を形成する仕組みの詳細を大腸菌において明らかにしました。この研究内容が本日(9/18)の Cell 誌に掲載されました。
掲載論文
Kadokura, H., Beckwith J. (2009) Detecting folding intermediates of a protein as it passes through the bacterial translocation channel. Cell, 138, 1164-1173.
生命を担うタンパク質は多数のアミノ酸が連なったひも状の分子としてリボゾーム上で合成された後、正しい立体構造に折り畳まれることによって正常な機能を発揮します。この折り畳み過程を解明することは生命の本質に関わる重要なテーマです。さて、細胞はホルモンなど多くのタンパク質を細胞外へと分泌します。分泌タンパク質は分子内に多数のジスルフィド結合(2つのシステイン間に形成される共有結合)を持っています。ジスルフィド結合の形成は多くの分泌タンパク質にとり立体構造形成上きわめて重要なステップです。よって、その仕組みの解明は分泌タンパク質の立体構造形成の理解に重要です。本研究科動物細胞工学講座(河野研究室)の門倉 広研究員(国際リサーチフェロー)は、その仕組みの詳細を大腸菌において明らかにしました。
大腸菌の分泌タンパク質は細胞質からその外側であるペリプラズムへと輸送され、ここで立体構造を形成します。ジスルフィド結合形成もここで進行します。ペリプラズムではDsbAと呼ばれる酵素が分泌タンパク質にジスルフィド結合を直接導入します。この過程で酵素のシステインの1つと分泌タンパク質のシステインの1つがジスルフィド結合で連結した反応中間体が形成されると予想されていました。今回、門倉研究員らは、立体構造形成中の分泌タンパク質上の2つのシステインが、この中間体をへてジスルフィド結合を形成する過程を追跡することに世界で初めて成功しました(図1)。
反応中間体の構造を解析したところ、分泌タンパク質上の特定のシステインが酵素との中間体形成に使われていました。このことから、ジスルフィド結合で最終的に連結される分泌タンパク質上の2個のシステインの各々は、ジスルフィド結合形成過程で、それぞれ異なる役割を果たしうることが分りました。更に、興味深いことにタンパク質のペリプラズムへの輸送がタンパク質の合成と同時に起こるかあるいは合成後に起こるかの違いによって、タンパク質の立体構造形成過程に違いが出てくることを突き止めました(図2)。このことから、リボゾームの活性が、サイトゾル以外で起こるタンパク質の立体構造形成過程にも影響しうることが初めて示されました。これらの結果は分泌タンパク質の立体構造形成を理解するうえでの基礎になる発見です。
本研究をまとめるにあたり、本研究科グローバルCOEプログラムの援助をうけました。
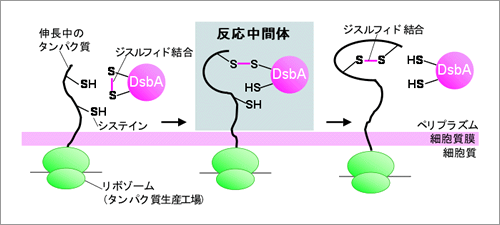
(図1) 大腸菌分泌タンパク質のジスルフィド結合形成機構
本研究では、反応過程で形成する中間体を検出しその解析をおこなった。その結果、反応の仕組みについて様々な新知見を得ることに成功した。
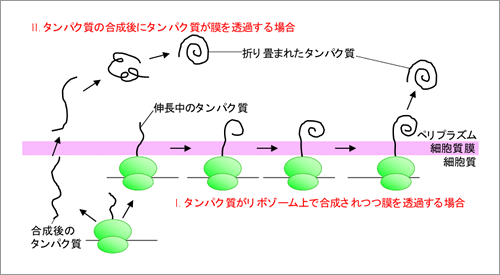
(図2) リボゾームの活性は分泌タンパク質の立体構造形成過程に影響し得る
リボゾーム上で合成されつつタンパク質がペリプラズムへと輸送される場合には、合成後に輸送される場合に比べて、タンパク質の輸送速度が遅くなると見積もられている。この輸送速度の違いが、ペリプラズムでの分泌タンパク質の折り畳み過程に影響していると予想している。
(2009年09月18日掲載)
 奈良先端科学技術大学院大学
奈良先端科学技術大学院大学