
研究テーマ
研究概要
植物は驚くほど精緻な免疫システムを備えており、環境中の微生物ときわめて巧妙かつダイナミックな相互作用を展開しています。実際、植物の体表や組織内には無数の微生物(エンドファイト)が顕著な病兆や防御応答を引き起こすことなく棲息しています。しかし、植物には、微生物の構成成分(MAMP)を検知して抵抗性を誘導する一連の免疫センサー(パターン認識受容体、PRR)が備わっています。もし免疫センサーがオンになって免疫が活性化されると、 微生物は撃退されてしまうでしょうし、植物にも生育の阻害などのコストがかかるはずです。どのようにして、植物と微生物との一見平和な共存関係は成立しているのでしょうか?
私達は、自らの細胞ダメージや破砕成分(DAMP)を認識して活性化されるシグナル系がMAMPシグナル系を増強するように働き、植物免疫の強化に寄与していることを突き止めました。したがって、微生物に共通のMAMPのみではなく、植物細胞の異常やダメージ(DAMPの有無)を指標にすることで、微生物の病原性(良性か悪性か)に基づいて免疫活性レベルを調節していると考えられます。一方、エンドファイトと病原菌は極めて近縁な関係にあることが分かってきており、植物への感染戦略には共通点も多々あると予想されます。またエンドファイトの中には貧栄養条件下で植物の生育を補助する能力を備えたものが居ます。植物は、状況によってこれらの微生物に対処する仕方を柔軟に変えていることも想像されます。
病原体に対して高い防御能力を発揮すると同時に、良性の微生物とは「持ちつ持たれつ」の相互作用を展開して生育に役立てることを可能にしているのが、植物の免疫システムです。私達は、植物の免疫制御や微生物の感染生理のメカニズムを分子レベルで明らかにすることで、持続的な耐病性技術や新しい植物生産技術の開発にも貢献しようと研究に取り組んでいます。
パターン受容体のシグナル制御
膜受容体が刺激(リガンド)に応じて細胞応答を巧みに調節する仕組みは、生物に必須の環境適応メカニズムです。植物は、微生物の構成成分(MAMP)や自らの細胞破砕成分(DAMP)を細胞表面の免疫センサー(パターン認識受容体、PRR)によって察知し、効果的に防御応答を展開することで病原体から身を守っています。植物のPRRは、リガンド結合ドメインによってロイシンリッチリピート(LRR)型かリジンモチーフ(LysM)型に大別できます。モデル植物であるシロイヌナズナでは、LRR受容体キナーゼ(RK)であるFLS2やEFRがそれぞれ細菌のフラジェリン(flg22エピトープ)や翻訳伸長因子EF-Tu(elf18エピトープ)の受容体として、またLysM-RKであるCERK1が糸状菌(カビ)の細胞壁成分であるキチンの受容体として働きます。LRR-RKであるPEPR1/PEPR2は植物自身がつくる免疫活性化因子 PROPEPペプチド(Pepエピトープ)を認識するDAMP受容体として働きます。PRRはリガンド認識直後にタンパク質複合体を形成し、活性酸素種(ROS)バースト、Ca2+バースト、MAPKの活性化、植物ホルモンであるエチレンやサリチル酸の産生、カロース沈着や抗菌性物質の産生、並びに遺伝子発現の大規模な変動を伴いながら病害抵抗性を誘導します。個々の防御応答の役割や関係性、制御メカニズムの解明に加えて、一つの受容体が多岐にわたるアウトプットを巧みに制御する仕組みという生物に普遍的な問題の解明にも取り組んでいます。
また、認識するリガンドは異なっても、PRRは概ね共通の防御応答セットを活性化するという観方がこれまで主流でした。しかし、私達は、個々のPRRシグナル系は独自のシグナル伝達経路や制御様式を持ち、互いの機能を相補することで植物免疫システムを強靭にしていることを見出して来ています。PRRの機能性ネットワークを支える仕組みの解明を通じて、植物免疫の基本制御原理に迫っていきたいと考えています。
PRRの機能性ネットワークは、細胞と細胞が協力し合って植物免疫を調節する際にも鍵をにぎっています。植物は各々の細胞が自律的な免疫システムを有していると同時に、細胞間コミュニケーションによって病原体の侵入部位から周囲の細胞・組織へとシグナルを伝えて個体全体の免疫を強化します。一方、防御応答や細胞死の誘導規模・範囲を最小限にとどめる仕組みも備えています。まず、PRRの機能性ネットワークにおいてどのステップが細胞自律的に(一つの細胞内で)あるいは細胞非自律的に(細胞間コミュニケーションによって)制御されているかを明らかにしようとしています。

植物免疫と環境応答のクロストーク

植物は野外では刻々と環境条件が変動する状況で病原体と対峙する必要があります。時には、特定のストレスへの応答を優先させて他を後回しにするという戦略を取りますが、その戦略決定ロジックや分子スイッチの実体については研究があまり進んでいません。シロイヌナズナは、紫外線や高濃度の糖(スクロース)に曝されると抗酸化作用のあるフラボノイドを蓄積します。しかし、同時にMAMPを投与するとフラボノイドの蓄積を犠牲にして免疫の活性化を優先します。私達はサリチル酸を介した防御応答とフラボノイドが互いに拮抗する関係にあり、フラボノイド代謝の制御が植物の複合ストレス応答において一つの鍵となっていることを見出しました。さらに、フラボノイドの抑制を指標としてMAMP応答に異常を示す変異体のコレクションを単離し、MAMPシグナル制御に重要な因子を多数同定して来ています。また、DAMPシグナル系はそもそも様々な環境ストレスによって生じる細胞ダメージに対応するシステムで、複合ストレス応答に重要な役割を担っていることも容易に推察されます。そこで、パターン受容体による免疫制御と、光・水分・温度・栄養条件などの環境条件の変動との関わり合いについて調べることで、生育や環境応答と調和の取れた植物防御システムのあり方を探ろうとしています。
植物免疫におけるヒストン修飾を介した遺伝子発現の制御
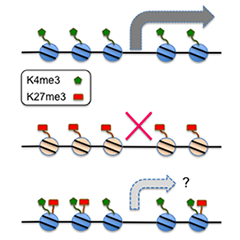
植物の各々の細胞には、微生物や内生のエリシター成分(MAMP/DAMP)をパターン受容体が認識すると誘導されるパターン誘導性免疫(PTI)と、病原体のもつエフェクター(感染促進因子)を抵抗性(R)タンパク質が認識すると誘導されるエフェクター誘導性免疫(ETI)が備わっています。PTIやETIが局所的に活性化されると、病原体と接していないシステミックな組織においても二次刺激への応答性や抵抗性が高まります(プライミング)。急激に増殖する病原体に対抗するには、ゲノムワイドで遺伝子発現の変動ひいては防御応答を素早く誘導することが重要ですが、つねにオンにしていると生理コストが非常に高くつきます。プライミングは、活性化の一歩手前の準備状態でとどめて低いコストで迅速な防御応答を可能にする仕組みです。また、長期間、次世代にも効果が伝わるという報告もあり、プライミングを活用することで生育調和型のストレス耐性育種が実現できると期待されます。私達は、ETIがPTIよりはるかに強いプライミングを成立させることや、この過程で標的遺伝子のヒストン修飾変化やヒストン修飾因子の重要性を示唆する知見を得ています。免疫シグナル系が多数の遺伝子のオン・オフの制御を一斉に強力に推進する仕組みや、防御応答に即したクロマチン状態を成立・維持する仕組みに関する理解を深めることで、植物のしなやかな環境応答やその記憶を担う分子機構の一端に迫ります。
内生型・病原型微生物の感染戦略と植物の免疫応答
植物の体表や組織内には無数のエンドファイト(植物に病気を起こさずに感染する内生・共生微生物)が棲息しています。植物の栄養吸収を補助したり、免疫活性化や間接防御によって植物の抵抗性を高めたりしていると考えられていますが、生理意義や感染生理については不明な点が多いのが現状です。エンドファイト細菌については、シロイヌナズナに内生する細菌叢のメタゲノム研究が推進されつつあります。一方、エンドファイト糸状菌(カビ)については、推定80パーセントの植物根に共生するアーバスキュラー菌根菌が最もよく研究されています。しかしながら、菌根菌は人工培養や遺伝子操作が極めて困難であること、モデル植物として抜群に優れたシロイヌナズナに感染できないことが、共生の遺伝子基盤を詳細に解明する上でネックになっています。
私達は、野外で生息するシロイヌナズナから単離したエンドファイト糸状菌Colletotrichum tofieldiae (Ct)をモデルとして、内生菌と植物の遺伝子相関について体系的に理解することを目指しています。Ctは宿主範囲も広く、リンや窒素が限られた貧栄養条件下で植物の成長を促進します。ゲノム配列を比較した結果、アブラナ科植物に病害を起こすC. higginsianum(Ch)およびトウモロコシに病害を起こすC. graminicola(Cg)と極めて近縁であることが判明し、内生菌と病原菌が進化的に極めて近い存在であることが示唆されました。そこで、Colletotrichum属の内生菌・病原菌コレクションを活用して両者の感染戦略の類似点や相違点を明らかにしていきます。同時に、両者に対する植物の免疫応答を(例えばDAMPの関与に着目するなどして)比較することで、植物が病原体と非病原体を識別する仕組みを明らかにしていきます。