成果報告
論文No.001
細胞膜プロトンポンプの活性制御に関わるリン酸化反応の生化学的解析
- 林優紀、中村英、武宮淳史、高橋洋平、島崎研一郎、木下俊則
- Plant & Cell Physiology 51, 1186-1196 (2010)
Hayashi, Y., Nakamura, S., Takahashi, Y., Shimazaki, K. and Kinoshita, T. (2010) Biochemical characterization of in vitro phosphorylation and dephosphorylation of the plasma membrane H+-ATPase. Plant & Cell Physiology 51: 1186-1196
植物の細胞膜に存在するP型ATPase細胞膜プロトンポンプは、ATPの加水分解エネルギーを利用したプロトンの能動輸送を行うことによって、細胞膜を介したプロトンの電気化学ポテンシャル勾配を形成し、様々な二次輸送体と共役したイオンや代謝物質の輸送を駆動する植物細胞に必須の一次輸送体である。これまでの当研究室の気孔孔辺細胞を用いた研究により、プロトンポンプの活性化には、C末端から2番目のスレオニンのリン酸化が必須であることが明らかとなっているが、このリン酸化反応を触媒するプロテインキナーゼやホスファターゼの実体やこれらの生化学的性質は未だ明らかとなっていない。
本論文では、シロイヌナズナ黄化芽生えから精製した細胞膜を用いて、in vitroリン酸化反応系を確立し、生化学的解析を行った。その結果、キナーゼとホスファターゼがプロトンポンプと共に細胞膜に局在しており、キナーゼは一般的なキナーゼ阻害剤(K-252a)に対して非感受性であり、その活性には細胞膜構造が必要であること、一方、ホスファターゼは、Mg-依存性のタイプ2Cホスファターゼであり、プロトンポンプと複合体を形成していることが明らかとなった。現在、これらキナーゼやホスファターゼ分子の同定に向け、解析を進めている。
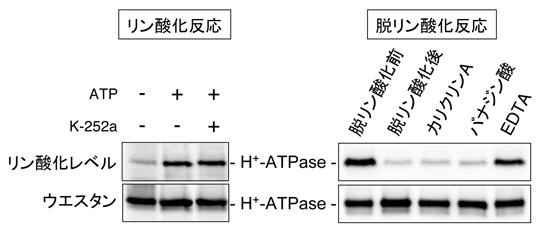
図1 シロイヌナズナ黄化芽生え細胞膜における細胞膜プロトンポンプのin vitroリン酸化・脱リン酸化反応
単離した細胞膜画分中でプロトンポンプはATPに依存してリン酸化され、その反応はキナーゼ阻害剤K-252aの影響を受けなかった(左)。また、プロトンポンプの脱リン酸化反応も細胞膜において観察され、この反応はタイプ2Cホスファターゼを阻害する2価カチオンキレート剤EDTAにより特異的に阻害された(右)。なお、リン酸化反応には、あらかじめ脱リン酸化処理した細胞膜を用いた。カリクリンA;タイプ1/2Aホスファターゼ阻害剤、バナジン酸;Tyrホスファターゼ阻害剤。
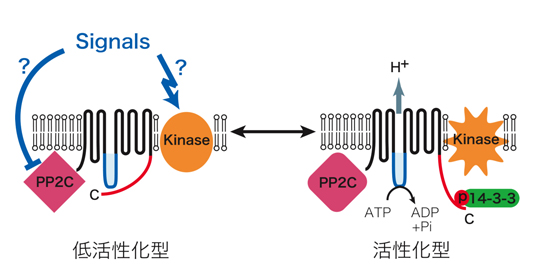
図2 細胞膜プロトンポンプ活性制御モデル図
キナーゼ(Kinase)とホスファターゼ(PP2C)はプロトンポンプと共に細胞膜に局在して、活性化に重要なC末端のリン酸化レベルを調節する。
