SecDFの新規構造解析
細胞膜を越えるたんぱく質輸送の新たな機構を解明
~通り道を塞ぐキャップを開閉して制御 細胞内における基本的な生命現象の理解へ~
Furukawa A, Yoshikaie K, Mori T, Mori H, Morimoto VY, Sugano Y, Iwaki S, Minamino T, Sugita Y, Tanaka Y, *sukazaki T. tunnel formation inferred from the I-form structures of the proton-driven protein secretion motor SecDF cell rep. 19, 895-901 (2017).
概要
すべての生物は細胞膜によって外界と隔離された細胞システムを持っています。また、細胞膜を通して細胞内で合成されたタンパク質を細胞外に輸送することも、生命の維持にとって不可欠な現象です。バクテリア(細菌)では、細胞膜に存在する分子モータータンパク質「SecDF」という輸送役のタンパク質が、水素イオンの濃度の変化による濃度勾配から得られるエネルギーを利用して、合成したタンパク質を細胞外へと牽引すると考えられています。しかし、膜透過するタンパク質に働きかける部位や水素イオンの通り道など、SecDFの詳細は不明のままでした。私たちは,SecDFの立体構造をこれまでにない高い分解能(2.6-2.8Å分解能)で決定することに成功しました。また,生化学的な実験やコンピュータを用いて分子の挙動を推測する分子動力学計算を進めました。その結果、膜透過するタンパク質とSecDFの結合部位を同定、水素イオンが通過しうる細胞膜内の道を見出しました。
さらなる解析によって、水素イオンの濃度勾配を利用してSecDFの全ドメインがダイナミックな構造変化をおこすことが考えられました。SecDFが駆動するタンパク質の膜透過の新しい分子メカニズムを提唱しました。本研究は、膜を超えたタンパク質の輸送メカニズムという生命に必須の現象を解明し生命科学の発展に寄与するとともに、バクテリアに特有のタンパク質であるSecDFを標的とした新規抗生物質の開発の構造基盤となります。
解説
(1) 研究背景
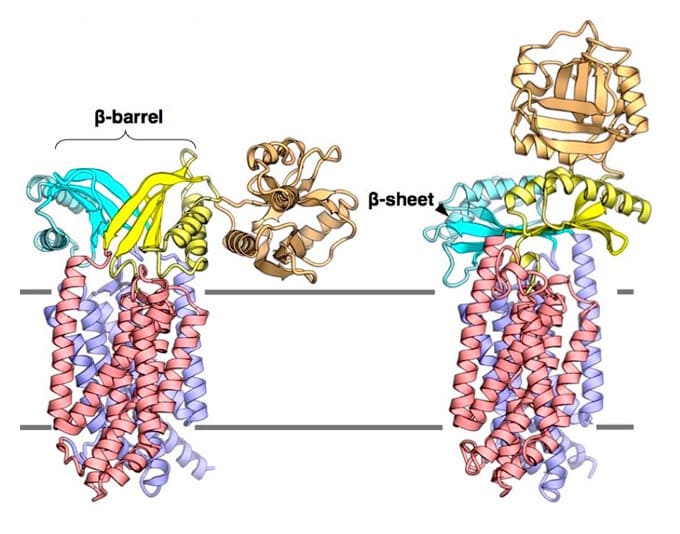
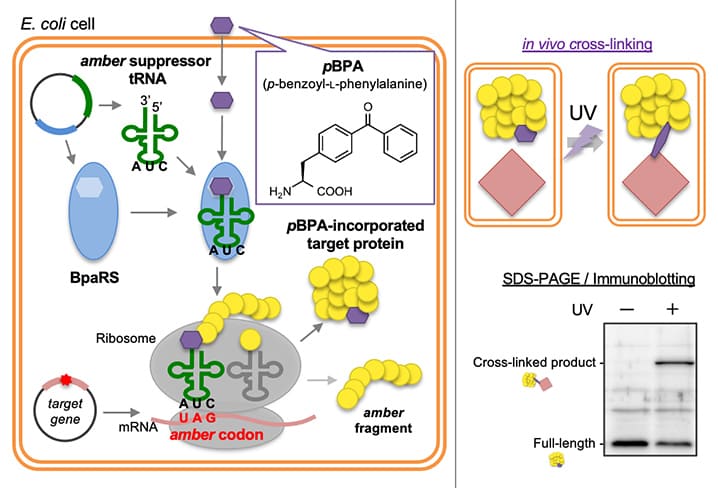
すべての細胞は、細胞膜によって外界と隔てられています。生命を維持するためには、細胞膜を介した適切な物質の輸送が必要です。生命にとって重要な物質の種々のタンパク質は、細胞質でリボソームによって合成されます。このタンパク質の約30%は、細胞膜を越えて外界へと輸送され機能します。これらのタンパク質は、すべての生物に保存された「Secトランスロコン(バクテリアではSecYEG複合体)」というトンネルを通って細胞外へと輸送されます(図1)。Secトランスロコンは受動的なトンネルであり、タンパク質の輸送には他のタンパク質を必要とします。バクテリアでは、2つのモータータンパク質SecAとSecDFが、この過程を駆動します。SecDFはバクテリアに特有の膜タンパク質で膜貫通ドメイン(領域)と細胞外ドメインからなります。SecDFは膜貫通ドメインを介した水素イオンの細胞内への流入に伴い、「F型」、「I型」といわれる2つの構造を繰り返しとることにより、SecYEGから出てきたタンパク質を捕まえ細胞外へと牽引するとされています。しかし、これまでに報告されているSecDFの全長構造はF型のみであり、さらなる詳細な議論を行うために高い解像度でのI型の情報が必要でした。
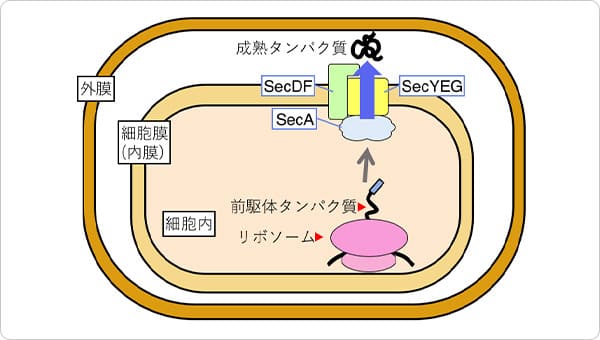
図1 バクテリアタンパク質の膜透過。
細胞内でリボソームにより合成された前駆体タンパク質は、タンパク質を押し出すモーターであるSecAにより細胞膜に存在するSecYEG内へと移動し、SecDFに牽引されて細胞外へ輸送され、成熟タンパク質となります。
(2) 研究内容
今回、本研究グループは、細菌Deinococcus radiodurans由来のSecDFのI型の結晶構造を高い分解能(2.6-2.8 Å分解能、1オングストロームは100億分の1㍍)で決定することに成功しました。SecDFを測定試料とするための結晶化は、脂質キュービック相(LCP)法という方法で行い、大型放射光施設SPring-8 BL32XU(ビームライン)においてX線回折データを収集しました。
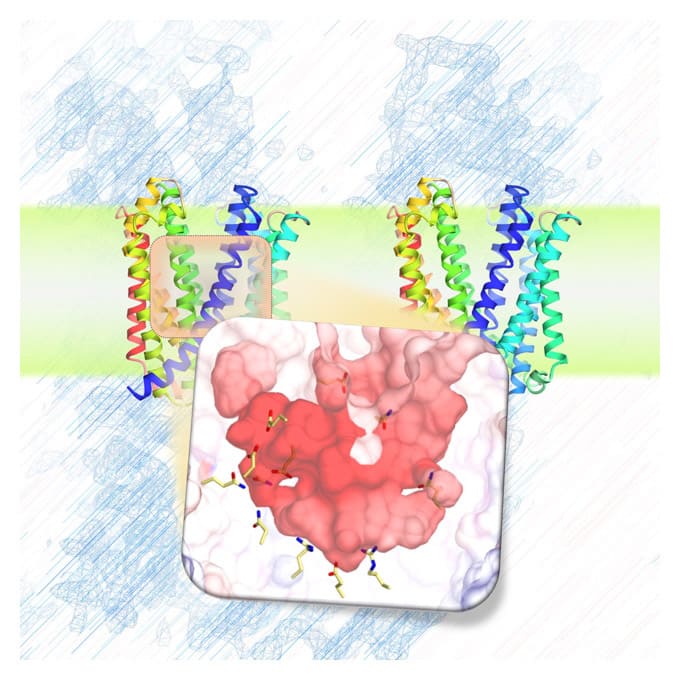
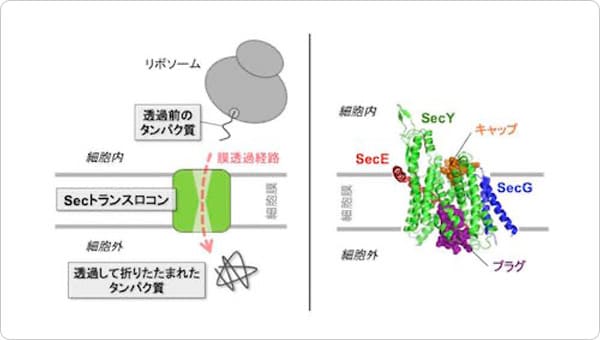
今回決定したSecDFのI型構造には、2つの特筆すべき特徴がみられました(図2)。1つめの特徴として、SecDFの細胞外ドメインの1つである「P1ドメイン」のくぼみにタンパク質の一部を模した小分子が結合していたことです。そこで、細胞外へと輸送されるタンパク質とSecDFの相互作用部位を生化学的な実験により確認したところ、このくぼみで特異的な相互作用が認められました。これらの結果から、このくぼみが輸送タンパク質の結合部位であることが予測されます。
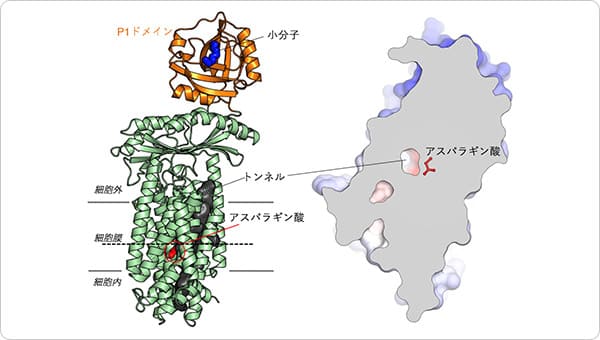
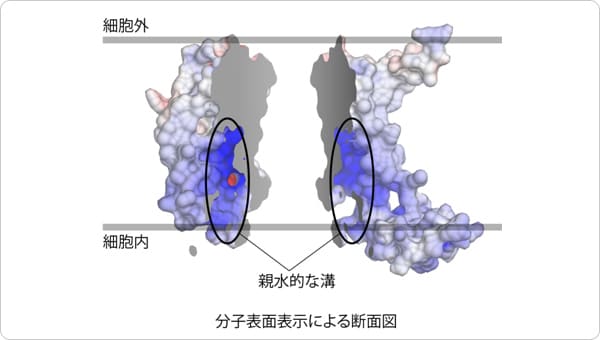
図2 I型SecDFの構造のリボンモデル図(左)。
細胞外のP1ドメインをオレンジ,P1ドメインのくぼみに結合した小分子を青、細胞膜を貫通するトンネルを黒で表示しました。また、トンネル内部に存在するSecDFの活性に重要なアスパラギン酸を赤で示しました。SecDF表面モデルを左図の点線部分で切り、細胞外側から見た断面図(右)。中央にトンネルが存在しているのがわかります。
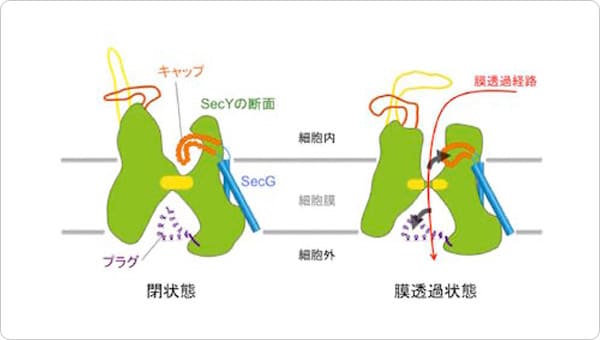
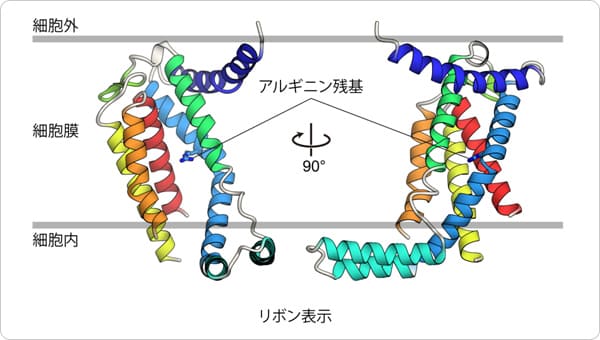
2つめの特徴として、SecDFの膜貫通領域ドメインに細胞内側から細胞外側まで貫通したトンネル構造が認められたことです。このトンネルの中心には、SecDFの機能(水素イオン透過とタンパク質輸送活性)に必須のアスパラギン酸が存在していたため、この領域が水素イオンの通り道であることが推測されます。コンピュータを用いたSecDFの分子動力学計算を行ったところ、このアスパラギン酸の水素イオンの結合状態の変化によりトンネルの開閉が起こること、トンネル内に水分子が入り込み水素結合を介して細胞質から細胞外まで一列に並ぶことが観察されました。こうしたことから、このトンネルを通って水素イオンが細胞外から細胞質へと流入すること考えられます。また、P1ドメインは可動性に富む領域ですが、この領域を固定したSecDFは水素イオンの流入とタンパク質の膜透過活性が阻害されたため、P1ドメインの動きと水素イオンとの関連性が示されました。
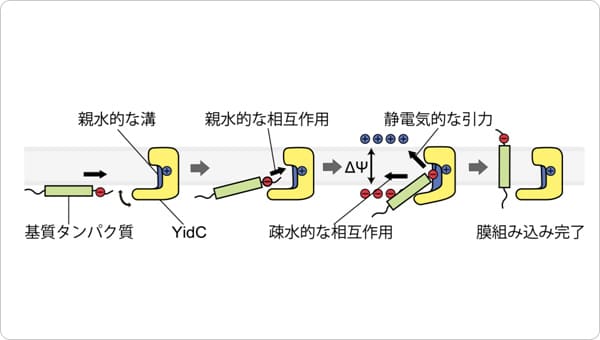
これら結果と過去の知見を組み合わせることで、「SecDFはF型の状態でP1ドメインのくぼみで輸送タンパク質と結合し、I型へと移行することで輸送タンパク質を細胞外へと牽引する。この構造変化は、膜貫通ドメインに形成されるトンネルに入り込んだ水分子を介した水素イオンの流入に伴い生じるエネルギーにより駆動される。このサイクルを繰り返すことによりタンパク質の輸送が達成される」という新規モデルを提唱しました(図3)。
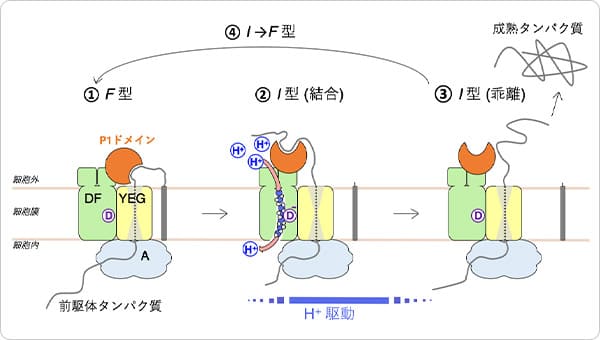
図3 SecDFによるタンパク質牽引モデル。
細胞内で合成されたタンパク質は膜へと運ばれ、SecYEGを通り細胞外へと輸送されます。その後、SecDFがF型の状態でP1ドメインのくぼみで輸送タンパク質と結合し、I型へと移行することで輸送タンパク質を細胞外へと牽引します。この構造変化は、膜貫通ドメインに形成されるトンネルに入り込んだ水分子を介した水素イオンの流入に伴い生じるエネルギーにより駆動されます。このサイクルを繰り返すことによりタンパク質の輸送が達成されます。トンネルの開閉は、アスパラギン酸(図中のD)の水素イオンの結合状態の変化(−電荷のとき開状態)により起こると考えられます。

ポイント